在过去的几十年里,止凝血机制以及病理方面的发展取得了巨大的进展。但是儿科患者的止血生理与成人存在显著差异,一系列的研究表明新生儿凝血因子水平远低于成年人,但是新生儿存在特殊的天然保护机制,其传统的凝血试验的结果却表现为高凝。儿童的凝血系统自出生后到发育成熟,不同阶段的实验室诊断标准也在发生变化,正确研究小儿血栓性和出血性问题是临床医生诊断和治疗患儿疾病的必要前提。本章主要介绍血栓弹力图对复杂的儿童凝血病的诊断、治疗和预后的应用。
▊ 血栓弹力图关于复杂的儿童凝血病的诊断、治疗和预后
凝血功能是一个逐渐发育成熟的过程,多种研究清楚地表明,新生儿的凝血因子在分子量和糖基化程度方面与成人是一致的,参与血液凝固过程的蛋白质生理浓度是随着时间逐渐增加的[1]。胎儿止凝血系统是处于动态中,逐渐向成人状态发展。有研究显示,不同胎龄的新生儿凝血功能检测指标存在差异,在早产儿中这种差异更为明显[2,3]。Reverdiau-Moalic 等人研究了儿童凝血因子和抗凝蛋白,结果显示儿童与成人凝血系统存在显著性差异(表 1 和表 2)[4]。依据成人的参考值,凝血功能检测结果异常的儿科患者,临床上却并未观测到明确的出血症状[4]。因此,这给临床医师评估小儿凝血功能带来了困难[5]。目前小儿凝血功能检测缺乏统一的参考标准,深入了解发育性止血是必不可少的。
表 1. 胎儿、足月新生儿和成人的凝血筛查和凝血因子水平
| 胎儿(怀孕周数) | |||||
凝血因子 | 19-23 (n = 20) | 24-29 (n = 22) | 30-38 (n = 22) | 新生儿 (n = 60) | 成人 (n = 60) |
I(g/L, Von Clauss) | 0.85 (0.57~1.50) | 1.12 (0.65~1.65) | 1.35 (1.25~1.65) | 1.68 (0.95~2.45)# | 3.0 (1.78~4.50) |
I Ag(g/L) | 1.08 (0.75~1.50) | 1.93 (1.56~2.40) | 1.94 (1.30~2.40) | 2.65 (1.68~3.60)# | 3.5 (2.50~5.20) |
IIc(%) | 16.9 (10~24) | 19.9 (11~30)* | 27.9 (15~50)# | 43.5 (27~64)# | 98.7 (70~125) |
VIIc(%) | 27.4 (17~37) | 33.8 (18~48)* | 45.9 (31~62) | 52.5 (28~78)# | 101.3 (68~130) |
IXc(%) | 10.1 (6~14) | 9.9 (5~15) | 12.3 (5~24)# | 31.8 (15~50)# | 104.8 (70~142) |
Xc(%) | 20.5 (14~29) | 24.9 (16~35) | 28.0 (16~36)# | 39.6 (21~65)# | 99.2 (75~125) |
Vc(%) | 32.1 (21~44) | 36.8 (25~50) | 48.9 (23~70)# | 89.9 (50~140) | 99.8 (65~140) |
VIIIc(%) | 34.5 (18~50) | 35.5 (20~52) | 50.1 (27~78)# | 94.3 (38~150) | 101.8 (55~170) |
XIc(%) | 13.2 (8~19) | 12.1 (6~22) | 14.8 (6~26)# | 37.2 (13~62)# | 100.2 (70~135) |
XIIc(%) | 14.9 (6~25) | 22.7 (6~40) | 25.8 (11~50)# | 69.8 (25~105)# | 101.4 (65~144) |
PK(%) | 12.8 (8~19) | 15.4 (8~26) | 18.1 (8~28)# | 35.4 (21~53)# | 99.8 (65~135) |
HMWK(%) | 15.4 (10~22) | 19.3 (10~26) | 23.6 (12~34)# | 38.9 (28~53)# | 98.8 (68~135) |
数值是平均数,括号内是上下限 95 置信区间;
缩写:Ag,抗原浓度;c,凝血活性;
*p < 0.05;#p < 0.01。
表 2. 胎儿、足月新生儿和成人中的抗凝蛋白差异
| 胎儿(怀孕周数) | |||||
| 抗凝蛋白 | 19 ~ 23 (n = 20) | 24 ~ 29 (n = 22) | 30 ~ 38 (n = 22) | 新生儿 (n = 60) | 成人 (n = 40) |
ATIII(%) | 20.2 (12~31)* | 30.0 (20~39) | 37.1 (24~55)# | 59.4 (42-BO[1] )# | 99.8 (65~130) |
HCII(%) | 10.3 (6~16) | 12.9 (5.5~20) | 21.1 (11~33)# | 52.1 (19~99)# | 101.4 (70~128) |
TFPI(ng/ml) | 21.0 (16.0~29.2) | 20.6 (13.4~33.2) | 20.7 (10.4~31.5)# | 38.1 (22.7~55.8)# | 73.0 (50.9~90.1) |
PC Ag(%) | 9.5 (6~14) | 12.1 (8~16) | 15.9 (8~30)# | 32.5 (21~47)# | 100.8 (68~125) |
PC Act(%) | 9.6 (7~13) | 10.4 (8~13) | 14.1 (8~18)* | 28.2 (14~42)# | 98.8 (68~129) |
Total PS(%) | 15.1 (11~21) | 17.4 (14~25) | 21.0 (15~30)# | 38.5 (22~55)# | 99.6 (72~118) |
Free PS(%) | 21.7 (13~32) | 27.9 (19~40) | 27.1 (18~40)# | 49.3 (33~67)# | 98.7 (72~128) |
数值是平均数,括号内是上下限 95 置信区间;
缩写:Ag,抗原浓度;c,凝血活性;
*p < 0.05;#p < 0.01。
对于儿童止凝血异常,无论是出血还是血栓,先天性的遗传或后天的获得性都是可能的。遗传性出血障碍包括因子 VIII、IX、V、VII、XI、X 和 XIII 的严重缺失,以及凝血酶原、纤维蛋白原和 α2-抗纤溶酶[6]。此外,原发性出血症状可能与血小板和血管性血友病因子(vWF)紊乱有关。后天性出血性疾病包括维生素 K 缺乏,导致维生素 K 依赖性凝血因子减少[7,8]。目前由于维生素 K 补充剂在出生时广泛使用,这类严重出血并发症的发生率已大大减少。此外新生儿的出血并发症可能与弥散性血管内凝血(继发于脓毒症或缺氧)、免疫性或非免疫性血小板减少性疾病或肝脏疾病有关。新生儿还可能出现导致血栓栓塞事件的危险因素,在婴儿和儿童中,静脉或动脉血栓形成的诊断和认识日益增多。在 10000 名儿童中有 5.3 名可观察到有血栓症状表现,先天性血栓前状态的危险因素包括蛋白 C、蛋白 S 和抗凝血酶 III 的缺乏,以及凝血酶原和 V 因子(导致活化蛋白 C 抗药性)变异[9-13]。
新生儿的凝血特点是高凝,血小板功能不足,早产儿和足月新生儿凝血指标也存在差异[14]。评估小儿凝血情况与成人相似,同样需要依靠临床症状,实验室检测和家族病史。呼吸困难、心理改变、低血压和毛细血管再灌注可用于评估血流动力学状态。然而,儿科病患者有良好的生理储备,即使在失去 25%~40% 的血容量后仍能维持动脉血压。因此,低血容量血症的临床体征和症状可能不是早期出血的良好预测因素。对于复杂的儿童凝血疾病,临床表现复杂多样,血液学变化亦十分复杂。例如系统性红斑狼疮患者可能出现免疫介导的血细胞减少,血小板功能异常,表现为出血倾向,少数存在凝血因子抗体的患者可出现明显的出血;同时患者凝血、抗凝、纤维蛋白溶解之间的动态平衡因其他病理机制破坏时,又可导致其出现血栓形成的倾向。因为血栓形成是各脏器损伤发生发展的重要因素,可导致严重并发症,明确患者出凝血紊乱状态对指导的治疗有重要价值。
检测项目各异,操作过程复杂,取血量大,对于儿童来说,大量的血液采样或重复的血液取样会导致医源性贫血,而且花费较多,单一类型检査结果仅能反映某一阶段或某个因子的凝血状态,没有提供有关凝块形成和止血异常的具体信息,如血小板功能障碍、纤溶亢进和第十三因子缺乏。而且多种检查结果的综合解读困难,甚至部分类似试验所得结论并不一致。目前出凝血检查体系对临床判断虽有一定的辅助作用,但对儿科多快好省的临床要求,根本无法满足。因此,迫切需要找到敏感有效、简单实用、用血量少的实验室检查来评价患者的总体凝血状态。应用血栓弹力图检测,实时测定患者的凝血情况,观察全血从凝血开始到纤溶的粘弹性特性。
血栓弹力图作为一种凝血功能检查目前在国内尚未广泛普及,由于其具有独特的优势,近年来国际上相关的研究、报道逐渐增多。通过检测凝血过程中血块的粘弹性变化,记录凝血因子激活、血凝块形成、纤维溶解的整个过程,将所得结果绘制成曲线,该曲线反映了凝血因子、血小板和纤维溶解系统的功能(图 1)。由于缺乏标准化检测方法,早期的临床应用价值受到一定限制,随着技术逐渐发展,其实验方法的标准化、可重复性明显改善,加上数字化检测过程、床旁评估出凝血功能等特点使得有关的研究和临床应用大大增加。
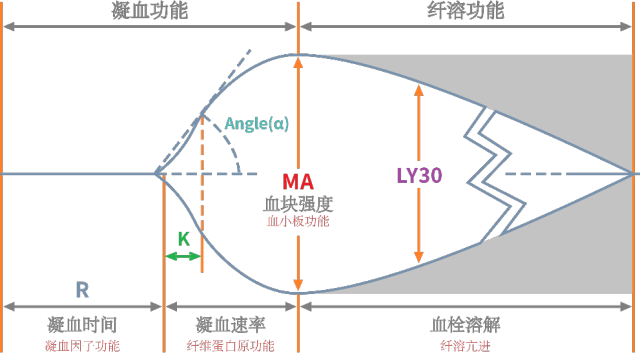
图 1. 血栓弹力图示意图
▊ 血栓弹力图儿童参考范围
虽然使用血栓弹力图来评估成人凝血病的研究越来越多,但是关于儿童应用的数据却是有限的。凝血蛋白的生理浓度与出生后的年龄以及出生时的胎龄有关,因此在临床广泛使用之前,确定特定年龄的规范测试参考数据是非常重要的。常用的血栓弹力图检测分为高岭土血栓弹力图试验(Kaolin thrombelastography,CK-TEG)与快速血栓弹力图试验(rapid thrombelastography,rTEG)。前者通过激活内源凝血途径完成检测,而后者通过同时激活内源和外源凝血途径完成检测,可进一步缩短检测时间。华中科技大学同济医学院附属同济医院收集小儿外科接受择期手术的 242 例患儿信息,通过检测凝血功能正常的择期手术儿童 CK-TEG 、rTEG,初步建立各年龄段儿童的弹力图参考区间(表 3 和表 4),为血栓弹力图在儿科患者中的合理应用奠定基础[15]。
表 3. 各年龄组 rTEG 参考区间
组别 | 例数 | ACT(s) | K(min) | Angle(º) | MA(mm) | LY30(%) | |
1 月~1 岁组 | 58 | 105 (89~123) | 0.9 (0.8~1.9)* | 79.3 (71.2~82.7)* | 64.2 (52.3~73.5)* | 0.2(3.7) | |
2~5 岁组 | 62 | 109 (89~121) | 1.2 (0.8~1.8)* | 3 (71.3~80.3)* | 61.7 (55.1~64.9)* | 0.0(1.5)# | |
6~10 岁组 | 62 | 113 (97~121)*# | 1.2 (0.9~2.0)*# | 76.6 (72.0~79.6)*# | 62.3 (56.0~67.6)* | 0.5(3.8) | |
11~16 岁组 | 60 | 113 (91~124) | 1.4 (0.9~2.2)# | 74.7 (68.0~78.8)# | 59.8 (52.4~68.4) | 0.1(3.4) | |
成人对照组 | 40 | 105 (95~120) | 1.6 (1.1~2.2) | 74.5 (68.0~78.7) | 58.9 (50.4~64.1) | 0.1(2.2) | |
注:与成人对照组比较,*p<0.05;与 1 个月~1 岁组比较,#p<0.05
表 4. 各年龄组 CK-TEG 参考区间
组别 | 例数 | R(min) | K(min) | Angle(º) | MA(mm) |
1 个月~1 岁组 | 58 | 4.4(2.3~6.5)* | 0.9(0.8~1.4)* | 78.9(75.1~83.1)* | 68.7(57~78.5)* |
2~5 岁组 | 62 | 5.2(2.8~7.2)# | 1.2(0.9~1.8)*# | 75.6(70.5~79.0)*# | 64(58.3~72.5)*# |
6~10 岁组 | 62 | 5.3(4.2~6.4)*# | 1.5(1.2~2.4)*# | 74.3(66.5~76.6)*# | 63.1(55.7~68.1)*# |
11~16 岁组 | 60 | 5.7(4.0~7.2)*# | 1.5(1.2~2.0)*# | 73.9(69~75.9)*# | 61.9(56.9~68.5)*# |
成人对照组 | 40 | 7.8(6.70~8.80) | 2.2(1.8~2.8) | 66.0(60.5~70.5) | 58.7(56.0~64.1) |
注:与成人对照组比较,*p<0.05;与 1 个月~1 岁组比较,#p<0.05
Mario Motta 等人研究早产儿的血栓弹力图参考区间,结果显示正常早产儿止血功能正常,解释原因可能为出生后促凝和抗凝达成稳态平衡,并表明血栓弹力图是评价新生儿出血高危指征的一种简单方法[16]。这一结果强化了儿科概念:在状态稳定的早产新生儿中,尽管凝血蛋白浓度发生了变化,但止血系统通常是平衡的和功能正常的。
▊ 血栓弹力图对复杂的凝血病的诊断
血栓弹力图是一种量化血凝块形成和降解过程的试验,它提供了对凝血系统的综合评价。目前,对凝血状态的评估需要多项检测报告综合解读,而且其检测标本来自多管血液样本。活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、国际标准化比率(INR)、纤维蛋白原水平、血小板计数和各凝血因子及抗凝蛋白浓度活性等指标反映了凝血系统的部分成分。而血栓弹力图反映凝血因子、血细胞和酶等成分高度复杂的反馈机制之间的相互作用。这可以通过微量全血快速评估血液动力学变化,凝块形成率,凝块强度和凝块稳定性。这些特征对于评估危重新生儿的凝血病具有一定的诊断价值[17]。
众所周知,血友病按凝血因子水平分为重度(<1%)、中度(1%~5%)或轻度(>5%)。然而,因子的活性并不一定与临床出血表现相对应。由于预防性治疗是预防血友病等严重并发症的最佳方法,因此可独立预测出血的试验将是非常有益的。止凝血涉及促凝蛋白、抗凝蛋白、血细胞和内皮细胞释放因子之间的复杂相互作用。近年来,在血友病的研究中,越来越多的人开始使用血栓弹力图等全血试验来测量血友病形成过程中粘弹性变化。Meera Chitlur 等人发现血栓弹力图显示出更快和更好的凝块形成的证据,如较高的最大凝血酶/纤维蛋白产生,与具有严重出血倾向的患者相比,除了预期的时间延长之外,与因子缺乏相关的凝块的形成也证明了这一点。这可能是评价出血倾向并确定在血友病儿童中预防的潜在有用的工具[18]。G. Young 等人的研究结果表明,高岭土激活剂在基线和加入 rFVIIa 后,对抑制物和非抑制剂患者的 R、K 和 angle 均大于组织因子。R 和 K 越长,对 rFVIIa 治疗效果的判别越好,从而使高岭土激活凝血途径是最敏感的检测方法。因此,建议利用血栓弹力图评估血友病患者治疗结果[19]。国际血栓和止血学会的科学和标准化委员关于血友病患者血栓弹力图应用的推荐方法,可归纳如下:1. 建议使用粘弹性检测仪器监测血友病患者凝血状态;2. 在临床使用中,建议使用高岭土激活内源性凝血途径[20]。
系统性红斑狼疮(SLE)是一种自身免疫介导的弥漫性结缔组织病,其受累系统广泛,临床表现复杂多样,血液学变化亦十分复杂。SLE 是儿童常见风湿性疾病之一,其血液学变化十分复杂,除了主要的免疫介导的血细胞减少外,血管内皮细胞(VEC)破坏[21]、抗磷脂抗体(APL)参与作用[22,23]、经尿液丢失 AT Ⅲ等抗凝蛋白、低蛋白血症使血液浓缩、大剂量应用糖皮质激素等多种复杂机制均可影响其凝血状态。SLE 患儿处于凝血紊乱状态,可呈现低凝状态,临床表现为皮肤黏膜及重要脏器出血,也可表现为高凝状态,出现血栓、栓塞事件。北京协和医院李卓等人应用血栓弹力图对 SLE 患儿的凝血状态进行了相关研究,发现 SLE 患儿处于凝血紊乱状态,其紊乱程度与疾病活动性有一定相关性[24]。研究样本中 1/39 例(2.6%)有出血表现,3/39 例(7.7%)SLE 患儿出现血栓,应用血栓弹力图检测 SLE 患儿的凝血功能,可以对其凝血功能进行快速的总体判断,有出血表现的 SLE 患儿,血栓弹力图检查结果显示 R、K 显著延长,α角、MA 减小,为明显低凝状态;另 3 例出现血栓事件的 SLE 患儿,血栓弹力图结果显示 R、K 缩短,为明显高凝状态(表 5)。结果显示了血栓弹力图作为一种全面检测凝血状态的检查项目对于 SLE 等复杂疾病的凝血情况判断的独特优势,推荐血栓弹力图作为评价 SLE 出凝血紊乱状态的方便易行的总体指标,对不同程度病情的患儿参考范围如表 6 所示。
表 5. SLE 患儿与正常对照组血栓弹力图参数比较
组别 | R / min | K / min | αangle / deg | MA / mm | LY30 / % | CI |
SLE(n = 58) | 5.75 ± 1.27 | 1.96 ± 0.51 | 62.92 ± 6.08 | 60.86 ± 5.77 | 0.20 ± 0.65 | -0.06 ± 1.64 |
出血(n = 1) | 32. 0 | 24.2 | 10.5 | 24.3 | 0 | -34.0 |
血栓(n = 3) | 3.83 ± 0.45 | 1.37 ± 0.25 | 70.47 ± 3.24 | 65.27 ± 5.16 | 0.17 ± 0.29 | 2.53 ± 1.18 |
对照组(n = 10) | 6.65 ± 0.93 | 2.36 ± 0.52 | 58.55 ± 10.47 | 58.46 ± 5.73 | 0.80 ± 0.53 | -1.55 ± 1.40 |
t(Z) | 2.142 | 2.317 | -1.863 | -1.216 | -2.56 | -2.711 |
p | 0.036 | 0.024 | 0.067 | 0.228 | 0.010 | 0.009 |
注:LY30 为非正态分布,数据表示为中位数与四分位数,并与秩检验比较
表 6. SLE 不同病情状态患儿的血栓弹力图参数比较
表型/频数 | R / min | K / min | αangle / deg | MA / mm | LY30 / % | CI |
严重 (n = 15) | 4.76±0.90 | 1.70±0.51 | 67.02±5.68 | 61.54±6.80 | 0.00±0.20 | 1.05±1.68 |
中度 (n = 15) | 5.99±1.581) | 1.87±0.53 | 63.56 ± 6.28 | 61.39±4.77 | 0.30±0.90 | -0.06±1.732) |
轻微 (n = 11) | 6.25±0.801) | 2.05±0.3 | 60.42±5.131) | 60.43±7.92 | 0.00±0.40 | -0.65±1.131) |
无症状 (n = 17) | 6.09±1.071) | 2.21±0.482) | 60.35±5.011) | 60.07±4.19 | 0.60±1.40 | -0.65±1.381) |
注:1)与严重症状组比较,p < 0.01;2)与严重症状组比较,p < 0.05。
此外血栓弹力图检测入院时的早期低凝状态可用于新生儿败血症的早期诊断,而低凝状态的程度可能与脓毒症的严重程度有关[25]。在一项对 103 名新生儿进行的前瞻性研究中,血栓弹力图在早期和确诊的脓毒症患者中发现了异常。结果表明,血栓弹力图的阳性预测值为 88%,阴性预测值为 98%。根据这些结果,作者得出结论:血栓弹力图能够检测出止血障碍,这为脓毒症的早期诊断提供了依据[26]。儿童川崎病多见于 5 岁以下儿童,其危害在于心血管系统的并发症,首都医科大学附属北京儿童医院检验中心靳剑云等研究血栓弹力图对儿童川崎病的诊断价值,对患儿样本进行连续监测各项参数的动态变化,并根据变化结果分析川崎病患儿凝血状态、危险分层及预后的关系。得出结论为联合检测 ATI 和血栓弹力图能够监测川崎病患儿的凝血状态,可辅助早期诊断川崎病,对预防川崎病患儿严重心血管并发症有积极的意义[27]。
▊ 血栓弹力图指导儿科患者输血及药物治疗
血栓弹力图可以预测早期大量输血,以及特定止血药物、凝血因子浓缩物和血液制剂的目标导向治疗。在多项队列研究中,这种基于快速即时检测的输血指导与减少输血需求、降低输血相关不良事件的发生率以及改善患者的预后有关。本文着重介绍血栓弹力图关于儿童输血的现状及困扰。
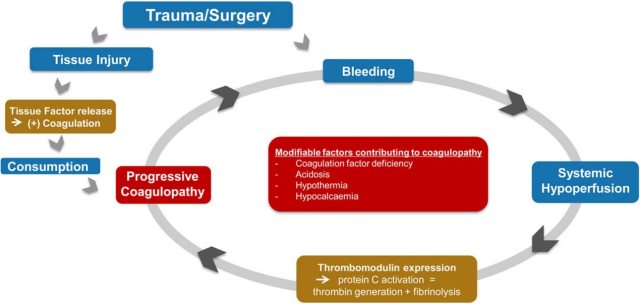
图 2. 大量输血期间导致凝血病的病理生理学因素
对大量出血的儿科病人的实验室评估具有挑战性,输血过程中患者的病理生理都在发生改变,患者血液管理要求评估初始失血和持续失血,并经常评估对治疗的反应,其目的是利用足够的血制品体积和成分进行复苏,以治疗和防止预期的凝血功能改变[28]。常规的凝血试验包括凝血酶原时间(PT)、部分凝血活酶时间(APTT)、血小板计数和纤维蛋白原水平都是耗时的。没有提供有关凝块形成和止血异常的具体信息,如血小板功能障碍、纤溶亢进和第十三因子缺乏。应用血栓弹力图实时测定患者目前的凝血情况,观察全血从凝血开始到纤溶的粘弹性特性,以更迅速和准确地指导血液产品的使用。Birgitta 等人研究提示,在小儿心脏手术中应用血栓弹力图指导输血可降低患者血制品输注[29]。
此外,血栓弹力图在 DIC 分期中也有一定的指导诊断作用。Wang 等人研究表明儿童 DIC 与血栓弹力图参数有良好的相关性(均 p < 0.01)[30]。华中科技大学同济医学院附属武汉儿童医院袁文浩等人研究发现常规凝血功能诊断 DIC 的指标特异度为:PT(27.2%),APTT(42.2%)和 D-二聚体(68.3%);把 R 时间<8 min 作为阴性时,血栓弹力图诊断 DIC 特异度为 85.1%,血栓弹力图诊断 DIC 灵敏度为 58.0%,常规凝血功能检测的特异度明显低于血栓弹力图[31]。血栓弹力图和常规凝血功能诊断试验各参数指标显示,血栓弹力图特异度最高的 3 个指标是 R 时间(85.1%)、α角(74.1%)和 MA 值(73.0%),而常规凝血功能检测的敏感度最高的 3 个指标是 FDP(83.5%)、D-二聚体(77.9%)和 FIB(71.3%)。常规凝血功能检测中除 D-二聚体之外的其他指标的诊断指数均低于血栓弹力图检测指标(MA 值、α角和 r 时间)(表 7)。儿童发生 DIC 时,相比较于常规凝血功能检测,血栓弹力图诊断 DIC 的特异性明显更高。血栓弹力图能更明确地诊断 DIC,与常规凝血功能检测互补,能更早地发现并诊断儿童 DIC,提高 DIC 患儿的生存率。与常规凝血功能检查相比,血栓弹力图对 DIC 的诊断具有更高的特异性,能更准确地诊断 DIC,同时结合传统凝血功能试验可以更早地发现和诊断 DIC。
表 7. 评估血栓弹力图和传统凝血检测
检测项目 | 参数 | 灵敏度(%) | 特异性(%) | 诊断指数 |
血栓弹力图 | R time(min) | 58.0 | 85.1 | 143.3 |
α angle(°) | 62.4 | 74.1 | 134.6 | |
Value of MA(mm) | 61.5 | 73.0 | 134.3 | |
Value of A(mm) | 52.6 | 62.7 | 114.5 | |
传统凝血试验 | D - dimer(mg/L) | 77.9 | 68.3 | 145.2 |
INR | 65.2 | 47.9 | 113.5 | |
FDP(mg/L) | 83.5 | 42.7 | 125.7 | |
FIB(g/L) | 71.3 | 44.4 | 114.6 | |
APTT(s) | 62.5 | 42.0 | 104.4 | |
PT(s) | 51.3 | 27.2 | 78.4 |
体外膜氧合(ECMO)期间的抗凝血是防止灾难性循环凝血的必要手段,但出血和血栓形成的并发症仍是导致患者严重并发症和死亡的重要原因。对于使用 ECMO 的儿童患者来说,他们不成熟的凝血系统更容易在体外循环中引起的炎症反应。无论选择何种组合的已知或新的抗凝药物,都必须满足以下条件:可供静脉使用;半衰期很短;是可逆的;并有持续的针对浓度和分子特异性效应的快速即时检测试验。一项调查发现,在 116 个附属于 ELSO 的国际 ECMO 中心中,有 50 个使用了血栓弹力图或旋转血栓弹性测量,大多数机构(80%)对于肝素酶对比分析都相当重视,认为在 ECMO 中可以发挥其相应优势,但是目前没有为抗凝的新生儿或儿童病人建立参考值[32]。Alexander 等人对接受 ECMO 的儿科患者进行了一次回顾性回顾,以探讨其与标准实验室测试的相关性,发现血栓弹力图参数与 APTT 和 ACT 之间的关系较弱,作者建议血栓弹力图成为儿科 ECMO 患者凝血监测的重要组成部分[33]。
此外,除输血治疗外,血栓弹力图还涉及到抗凝溶栓治疗。抗血栓治疗方案中涉及三种抗血栓药物:一种抗凝血剂,如华法林或依诺肝素,抗血小板抑制剂,如阿司匹林和双嘧达莫,以及溶栓药物。使用传统的凝血试验和血栓弹力图对抗血栓药物使用效果进行了评估时,由于不同的试剂供应商之间参考范围存在差异,不同人群之间也存在显著差异,且凝血试验对血液样本要求较高,不同采血时间、不同上机时间、甚至不同品规的采血管也可能造成检测差异。除了参考相应文献外,建议有条件的医院日常工作中收集相关数据建立本地人群本院的参考范围,建立个性化精准医疗[34]。
▊ 血栓弹力图对于患者的预后
出血和血栓是手术后重要的并发症之一,血栓弹力图能反映凝血过程全貌,评估高凝低凝状态,预测手术患者是否发生出血或深静脉血栓形成。Elizabeth 等人研究 2011 年 8 月至 2015 年 10 月期间一家儿童医院收治的 17 例临床有出血需要输血的婴儿血栓弹力图检测参数[35]。其用于预测临床出血的血栓弹力图参数的 ROCs 如图 3 所示,所有血栓弹力图参数在受试者操作特性曲线下均有较高的面积(AUC > 0.8)。选择最佳出血预测的 cutoff 为:R > 6.3(敏感性 82.4%,特异性 80%),K > 2.5(敏感性 82.4%,特异性 96.7%),α < 59(敏感性 82.4%,特异性 96.7%),MA < 57(敏感性 82.4%,特异度 86.7%),CI < −0.15(敏感性 88.2%,特异性 83.3%)。
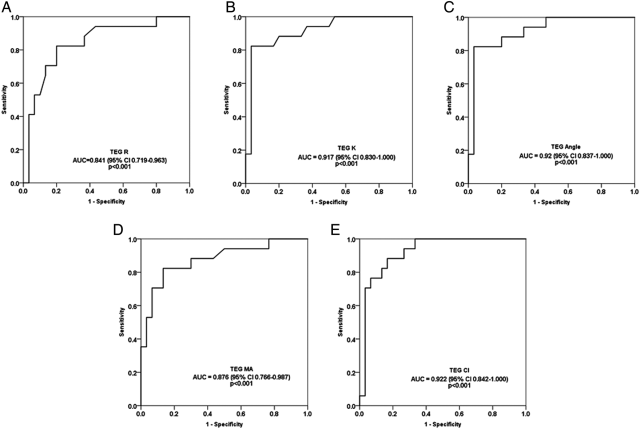
图 3. 血栓弹力图参数(A)凝血时间(R),(B)凝血动力学(K),(C)α角(α),(D)最大振幅(MA)和(E)凝血指数(CI)预测临床出血的操作特性曲线。AUC,受试者操作特性曲线下的面积。
哈尔滨医科大学附属第一医院检验科郑永晨等人探究儿童肾炎血液凝固性的变化,对 51 例儿童肾炎患者做血栓弹力图检测发现:儿童肾炎病人均有不同程度的凝血机能异常,主要表现为高凝状态,特别是尿毒症和急进性肾小球肾炎,以及有肾功能衰竭的病人[36]。各组病人的 TEG 结果均显示出以 MA/m(MA/m 是偏转率;MA 是 TEG 达到最宽时的幅度,其与血小板数量和纤维蛋白原的量有关,而 m 值是达到 MA 时所需的时间)比值明显高于正常人上限值为主要表现,因此,MA/m 比值增高就意味着血液凝固过程加快,在短时间内即达凝固的最大幅度,是判断肾炎病人血液凝固性的客观指标,适用于监测肾炎病人血液的凝固状态, 并为临床用药提供依据。
参考文献
[1] Lippi G, Franchini M, Montagnana M, et al. Coagulation testing in pediatric patients: the young are not just miniature adults[C]//Seminars in thrombosis and hemostasis. © Thieme Medical Publishers, 2007, 33(08): 816-820.
[2] 杨璐 , 李秋平, 许靖, 等. 不同胎龄新生儿凝血功能的临床研究 [J]. 国际检验医学杂志, 2013, 34(16): 2078-2079.
[3] Reverdiau-Moalic P, Delahousse B, Body G, et al. Evolution of blood coagulation activators and inhibitors in the healthy human fetus[J]. Blood, 1996, 88(3): 900-906.
[4] Christensen RD, Baer VL, Lambert DK, et al. Reference intervals for common coagulation tests of preterm infants (CME)[J]. Transfusion, 2014, 54(3): 627-632.
[5] Monagle P, Ignjatovic V, Savoia H. Hemostasis in neonates and children: pitfalls and dilemmas[J]. Blood Rev, 2010, 24(2): 63-68.
[6] Manco-Johnson M, Nuss R. Hemostasis in the Neonate[J]. Neoreviews, 2000, 1(10): e191-e195.
[7] Nurden A T, Freson K, Seligsohn U. Inherited platelet disorders[J]. Haemophilia, 2012, 18: 154-160.
[8] Franchini M, Lippi G. The role of von Willebrand factor in hemorrhagic and thrombotic disorders[J]. Critical reviews in clinical laboratory sciences, 2007, 44(2): 115-149.
[9] Nowak-Göttl U, Kosch A, Schlegel N. Neonatal thromboembolism[C]//Seminars in thrombosis and hemostasis. Copyright© 2003 by Thieme Medical Publishers, Inc., 333 Seventh Avenue, New York, NY 10001, USA. Tel.:+ 1 (212) 584-4662, 2003, 29(02): 227-234.
[10] Heller C, Nowak-Göttl U. Maternal thrombophilia and neonatal thrombosis[J]. Best Practice & Research Clinical Haematology, 2003, 16(2): 333-345.
[11] Nowak-Göttl U, Kosch A, Schlegel N, et al. Thromboembolism in children[J]. Current opinion in hematology, 2002, 9(5): 448-453.
[12] Nowak-Göttl U, Duering C, Kempf-Bielack B, et al. Thromboembolic diseases in neonates and children[J]. Pathophysiology of haemostasis and thrombosis, 2003, 33(5-6): 269-274.
[13] Greenway A, Massicotte M P, Monagle P. Neonatal thrombosis and its treatment[J]. Blood reviews, 2004, 18(2): 75-84.
[14] Koltsova E M, Balashova E N, Ignatova A A, et al. Impaired platelet activity and hypercoagulation in healthy term and moderately preterm newborns during the early neonatal period[J]. Pediatric research, 2019, 85(1): 63.
[15] 夏丽波, 简翠, 张碧玉, 等. 儿童血栓弹力图参考区间建立及与常规凝血项目的比较 [J]. 检验医学, 2017, 32(2): 81-85.
[16] Motta M, Guaragni B, Pezzotti E, et al. Reference intervals of citrated-native whole blood thromboelastography in premature neonates[J]. Early human development, 2017, 115: 60-63.
[17] Sewell E K, Forman K R, Wong E C C, et al. Thromboelastography in term neonates: an alternative approach to evaluating coagulopathy[J]. Archives of Disease in Childhood-Fetal and Neonatal Edition, 2017, 102(1): F79-F84.
[18] Chitlur M, Warrier I, Rajpurkar M, et al. Thromboelastography in children with coagulation factor deficiencies[J]. British journal of haematology, 2008, 142(2): 250-256.
[19] Young G, Zhang R, Miller R, et al. Comparison of kaolin and tissue factor activated thromboelastography in haemophilia[J]. Haemophilia, 2010, 16(3): 518-524.
[20] Chitlur M, Rivard G E, Lillicrap D, et al. Recommendations for performing thromboelastography/thromboelastometry in hemophilia: communication from the SSC of the ISTH[J]. Journal of Thrombosis and Haemostasis, 2014, 12(1): 103-106.
[21] Rajagopalan S, Somers E C, Brook R D, et al. Endothelial cell apoptosis in systemic lupus erythematosus: a common pathway for abnormal vascular function and thrombosis propensity[J]. Blood, 2004, 103(10): 3677-3683..
[22] Horbach D A, Oort E V, Donders R C J M, et al. Lupus anticoagulant is the strongest risk factor for both venous and arterial thrombosis in patients with systemic lupus erythematosus[J]. Thrombosis and haemostasis, 1996, 76(06): 0916-0924.
[23] Afeltra A, Vadacca M, Conti L, et al. Thrombosis in systemic lupus erythematosus: congenital and acquired risk factors[J]. Arthritis Care & Research: Official Journal of the American College of Rheumatology, 2005, 53(3): 452-459.
[24] 李卓, 肖娟, 宋红梅, 等. 血栓弹力图评估儿童系统性红斑狼疮出凝血状态 [J]. 中国循证儿科杂志, 2014, 9(2): 127-131.
[25] Sokou R, Giallouros G, Konstantinidi A, et al. Thromboelastometry for diagnosis of neonatal sepsis-associated coagulopathy: an observational study[J]. European journal of pediatrics, 2018, 177(3): 355-362.
[26] Grant H W, Hadley G P. Prediction of neonatal sepsis by thromboelastography[J]. Pediatric surgery international, 1997, 12(4): 289-292.
[27] 靳剑芸, 李启亮, 宋文琪. 血浆血栓弹力图与抗凝血酶Ⅲ检测对儿童川崎病诊断的应用价值 [J]. 现代检验医学杂志, 2017, 32(5): 130-132.
[28] Blain S, Paterson N. Paediatric massive transfusion[J]. Bja Education, 2015, 16(8): 269-275.
[29] Romlin B S, Wåhlander H, Berggren H, et al. Intraoperative thromboelastometry is associated with reduced transfusion prevalence in pediatric cardiac surgery[J]. Anesthesia & Analgesia, 2011, 112(1): 30-36.
[30] Wang Y, Lu G, Lu Z, et al. Effect of thrombelastography in the diagnosis of disseminated intravascular coagulation in children[J]. Zhonghuaerke za zhi = Chinese journal of pediatrics, 2014, 52(2): 128-132.
[31] 袁文浩, 刘汉楚, 曾凌空, 等. 儿童发生 DIC 的血栓弹力图指标变化及其诊断 DIC 的敏感度和特异度分析 [J]. 中国实验血液学杂志, 2017, 25(3): 847-852.
[32] Stocker C F, Horton S B. Anticoagulation strategies and difficulties in neonatal and paediatric extracorporeal membrane oxygenation (ECMO)[J]. Perfusion, 2016, 31(2): 95-102.
[33] Alexander D C, Butt W W, Best J D, et al. Correlation of thromboelastography with standard tests of anticoagulation in paediatric patients receiving extracorporeal life support[J]. Thrombosis research, 2010, 125(5): 387-392.
[34] Murray J M, Hellinger A, Dionne R, et al. Utility of a dedicated pediatric cardiac anticoagulation program: the Boston Children’s Hospital experience[J]. Pediatric cardiology, 2015, 36(4): 842-850.
[35] Sewell E K, Forman K R, Wong E C C, et al. Thromboelastography in term neonates: an alternative approach to evaluating coagulopathy[J]. Archives of Disease in Childhood-Fetal and Neonatal Edition, 2017, 102(1): F79-F84.
[36] 郑永晨, 陈沙力, 孙景辉, 等. 儿童肾炎血栓弹力图的变化 [J]. 吉林医学, 1996, 17(2): 67-68.
